
摘要:精心设计表格,以分组实验为抓手,从离子变化的角度分析实际问题,通过表格向导,渐次建构离子反应、离子方程式、离子方程式的意义、离子反应发生的条件等核心概念;借力迷思概念,以深化探究为平台,提升对离子反应发生条件的认识,学会规范书写离子方程式,体验离子反应在生产生活中的应用。凸显化学思维特征,顺势建构实验观、微粒观和守恒观等化学基本观念。
关键词:化学思维特征,离子反应;离子方程式;化学观念
新课程倡导“观念建构”的教学,提倡以具体知识为载体,注重知识的认知过程,把握概念间的联系和迁移,形成基本的化学观念,并运用化学观念加深对化学知识的整体、本质和特征的认识。
知识是观念建构的载体,观念是知识建构的引导。笔者依据“追求知识与观念双重建构”的教学目标,对课程标准和实验教材进行了重新解读;遵循“从宏观、微观和符号三种水平上认识和理解化学知识,并建立三者之间的内在联系”这一化学学科特有的思维方式,对“离子反应及其条件”课堂教学的进行了重新定位。从宏观的实验探究入手,结合反应过程的微观分析,落实反应本质的符号表征,强化“微粒观”、“实验观”和“守恒观”等化学观念的建构与体验。
1 课标与教材解读

2 教学设计的指导思想
凸显化学思维特征:以实验探究为平台,引导学生宏观观察反应现象,微观分析反应过程,符号表征反应实质,并通过离子方程式解读化学反应的信息。
顺势建构化学观念:以化学知识为载体、以学生活动为形式、以引发思维为过程,落实“实验观”、“微粒观”和“守恒观”的建构与体验,让学生站在化学观念的高度深刻理解“离子反应”、“离子方程式”、“离子反应发生的条件”等核心概念,灵活解决生产生活中涉及离子反应的实际问题。
引导学生自主建构:把握概念间的逻辑联系,依据知识发展的脉络,用精心设计的表格为学生搭建学习平台,让学生在表格的向导下,通过实验、分析、交流等手段自主建构核心概念,深化对离子反应规律的理解,规范离子方程式的书写。
3 教学实施策略
3.1精心设计教学目标,追求知识和观念的双重建构
知识建构目标——通过实验探究引发分析思考,渐次建构“离子反应”、“离子方程式”、“离子方程式的意义”、“难电离物质”、“离子反应发生的条件”等核心概念。正确掌握离子方程式的书写方法。用离子反应的视野深入理解氯离子检验和粗盐提纯的化学原理。
观念建构目标——从实验现象的宏观观察,到反应过程的微观分析,再到反应实质的符号表征,让学生感受化学科学特有的思维特征;从离子运动和变化的角度理解化学反应的实质,用离子浓度降低的标准把握离子反应发生条件,注重微粒观的建构;体验实验探究在化学学习中的价值,通过对比实验和数字化实验技术的运用,感受实验方法的优化对形成正确认识的意义,充实实验观的建构;强调离子方程式的规范书写遵循电荷守恒和质量守恒的原则,强化守恒观的建构。
3.2精心设计教学环节,实现知识和观念的双重建构
3.2.1精心设计表格,引领思维发展,建构核心概念
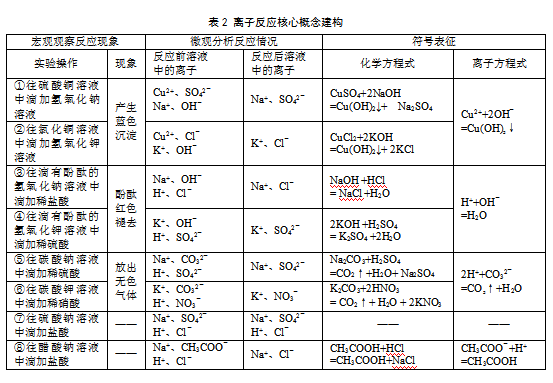
⑴按表2要求完成分组实验①~⑥,填写实验现象和对应的化学方程式。
⑵在表2“微观分析反应情况”的引领下,结合电解质在溶液中的电离情况,分组交流实验①~⑥溶液中的离子在反应前后的变化,揭示化学反应的实质,建构离子反应的概念。
⑶启发学生用实际参加反应的离子符号表征化学反应的实质,建构离子方程式的概念。
⑷对比实验①和②,③和④,⑤和⑥的化学方程式和离子方程式,认识离子方程式的意义——可以表示一种类型的离子反应。鼓励学生列举三个离子方程式所能代表的另一反应的化学方程式,深化对离子方程式意义的理解,捕捉迷思概念——CO32-+2H+=CO2↑+H2O表示碳酸钙与盐酸的反应,H++OH-=H2O可表示氢氧化钡溶液与硫酸的反应。
⑸依据表2实验①~⑥,引导学生归纳复分解型离子反应发生的条件(生成沉淀、气体或水),并通过讨论交流将认识上升到离子间通过反应导致离子浓度降低的高度。
⑹按表2要求完成分组实验⑦~⑧,分组交流反应能否发生并阐述判断依据。捕捉迷思概念——醋酸钠与盐酸不反应,复分解型离子反应一定要生成沉淀、气体或水。
3.2.2深化探究学习,提升认知水平,消弭迷思概念

[深化探究1]醋酸钠溶液与盐酸是否反应
实验操作:①取等体积两份稀盐酸,其中一份中加入浓醋酸钠溶液,另一份加入与浓醋酸钠溶液等体积的水②测定并比较两份溶液的pH值。
实验现象:加入醋酸钠溶液的那份稀盐酸pH较大。
现象分析:pH较大,则c(H+)较小,Cl-g与H+在稀溶液中不反应,表明CH3COO-与H+发生了反应,生成了难电离的CH3COOH。
符号表征:H++CH3COO-=CH3COOH
提升认识:复分解型离子反应发生条件:生成难溶物质、挥发性物质和难电离物质。
告知学生弱酸(CH3COOH)、弱碱(NH3·H2O)和水是常见的难电离物质。
[深化探究2]氢氧化钡溶液与硫酸反应的定量分析
实验操作:往氢氧化钡溶液中逐滴加入稀硫酸,跟踪测定反应过程的溶液pH值和电导率变化。
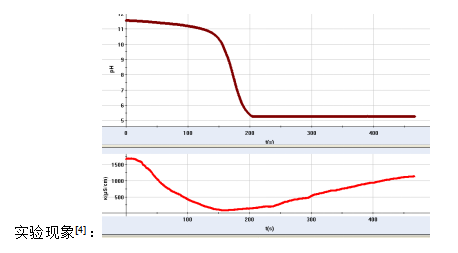
现象分析:定性分析——Ba2+、SO42-结合为BaSO4沉淀;H+、OH-结合成H2O。定量分析——当pH≈7时(OH-+H+=H2O反应完成),电导率近似为零(Ba2++SO42-= BaSO4↓反应完全),从Ba(OH)2的组成可知参加反应的Ba2+和2OH-之比为2:1,
符号表征:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
提升认识:通过数字化实验的演示,引导学生认识氢氧化钡溶液中滴加硫酸,同时发生OH-+H+=H2O,Ba2++SO42-=BaSO4↓两个离子反应,且两者间存在特定的量的关系,书写离子方程式必须依据客观事实准确反映出这种内在联系。
[深化探究3]离子方程式的规范书写
研读教材p32,领悟“拆”的原则——可溶于水且完全电离的物质(强酸、强碱、绝大多数可溶性盐)拆成离子形式,其余物质(难溶物质、难电离物质、气体等)需保留化学式。“查”的目标——是否满足电荷守恒和质量守恒意识的客观事实。完成碳酸钙与盐酸反应的离子方程式的正确书写。
3.2.3联系生产生活,解决实际问题,体验学习价值
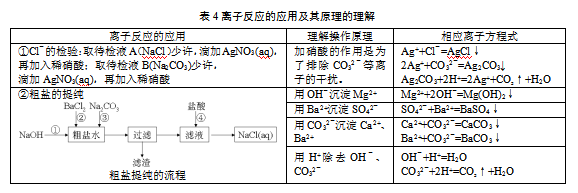
以学生熟悉粗盐提纯和氯离子检验为情境,通过对比实验和流程分析,从离子反应的角度领悟氯离子检验中稀硝酸的作用,理解粗盐提纯过程中各种试剂添加的用量与顺序,把握过滤操作的时机,深化对粗盐提纯化学原理的理解,强化离子方程式的书写训练。
3.2.4盘点学习收获,巩固基础知识,强化观念建构
[知识篇]
①离子反应——有离子参加的化学反应
②离子方程式——用实际参加反应的离子符号来表示反应的式子
③离子方程式的意义——能表示同一类型的离子反应
④复分解型离子反应发生的条件——生成难溶物质、挥发性物质、难电离物质(弱酸、弱碱、水是常见的难电离物质)
⑤离子方程式书写的一般步骤:“写”、“改”、“删”、“查”
[观念篇]
①从离子变化的角度认识化学反应的本质,从离子浓度变化的角度把握离子反应进行的方向。
②实验是化学学习和研究的重要方法,实验方案的严谨是取得正确认识的前提,实验方法的优化是提高认识水平的保障。离子方程式必须正确反映实验事实。
③电荷守恒、质量守恒是书写离子方程式必须遵循的原则,也是判断离子方程式书写正确与否的一种判据。
[参考文献]
[1]中华人民共和国教育部制订.普通高中化学课程标准(实验). 北京:人民教育出版社,2003:11
[2]宋心琦主编.普通高中课程标准实验教科书:化学(必修1)[M]. 第3版,北京:人民教育出版社,2007:31~33
[3]王祖浩主编.普通高中课程标准实验教科书:化学(必修1)[M]. 南京:江苏教育出版社,2004:47~48
[4]王磊主编.普通高中课程标准实验教科书:化学(必修1)[M]. 济南:山东科学技术出版社,2004:41~43
[5]保志明。运用实验体现概念的建构过程——“离子反应的教学与思考”[J]。中学化学教学参考,2012,(7):16-17
[文章改天于《化学教与学》2014年第1期,《中学化学教与学》2014年第4期全文转载]




13